
产品简介
海纳安®(氘恩扎鲁胺软胶囊)是海创药业基于其核心氘代药物研发平台自主开发的,具有自主知识产权的新型雄激素受体(AR)抑制剂,用于治疗转移性去势抵抗性前列腺癌(mCRPC),获国家“十三五”重大新药创制科技重大专项的支持。氘恩扎鲁胺软胶囊是国内首款获批上市治疗该适应症的国产创新药物,具有更优化的药代动力学特征。相较于其他新型内分泌药物,氘恩扎鲁胺软胶囊在药物分子结构上进行了重要创新,使得药物在具有AR抑制高活性的同时在安全性方面表现优异,可显著降低中枢神经系统不良事件(如癫痫、跌倒等)发生率,且无皮疹相关不良反应,同时减少老年患者常见并发症风险。
氘恩扎鲁胺(HC-1119)中国Ⅲ期临床试验已达到主要研究终点,临床Ⅲ期数据入选2023年6月美国临床肿瘤学会(ASCO)年会,氘恩扎鲁胺HC-1119-04注册研究信息纳入2023版CSCO前列腺癌诊疗指南。2025年5月底氘恩扎鲁胺软胶囊正式获得中国国家药品监督管理局(NMPA)批准上市,中国前列腺癌患者有了新的治疗选择。2025年12月通过国家医保谈判,首次被纳入国家医保药品目录,2025版CSCO前列腺癌诊疗指南将其纳入mCRPC的全线推荐治疗方案。
药品信息
批准文号 | 国药准字H20250029 |
| 产品名称 | 氘恩扎鲁胺软胶囊 |
英文名称 | Deutenzalutamide Soft Capsules |
商品名 | 海纳安® |
| 药品类型 | 处方药 |
剂型 | 胶囊剂 |
| 规格 | 40mg |
适应症
本品适用于接受醋酸阿比特龙及化疗后出现疾病进展,且既往未接受新型雄激素受体抑制剂的转移性去势抵抗性前列腺癌(mCRPC)成人患者。
性状
本品为类白色椭圆形胶囊,内容物为淡黄色的澄明油状液体。
成分
本品活性成份为氘恩扎鲁胺。
化学名称:4-[3-[4-氰基-3-(三氟甲基)苯基]-5,5-二甲基-4-氧代-2-硫代-1-咪唑烷基]-2-氟-N-三氘代甲基苯酰胺
化学结构式:
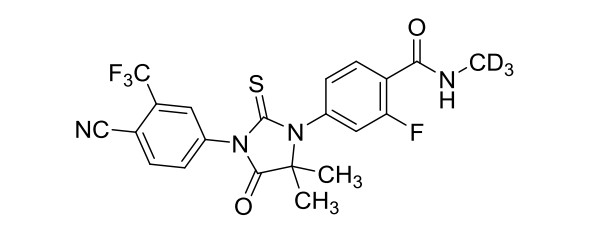
分子式:C₂₁H₁₃D₃F₄N₄O₂S
分子量:467.45
辅料:辛酸癸酸聚乙二醇甘油酯,丁基羟基茴香醚,二丁基羟基甲苯,胶囊用明胶,甘油(供注射用),山梨醇山梨坦溶液,二氧化钛。
用法用量
推荐剂量:
氘恩扎鲁胺的推荐剂量为80 mg(2粒40 mg/粒软胶囊),每日一次,口服。
患者还应同时接受雄激素剥夺治疗,即同时接受促性腺激素释放激素类似物 GnRHa)治疗或已接受过双侧睾丸切除术 。
如果患者未能按时服药,应尽快在当天补服处方剂量。如果错过服药一整天,应于次日仍按平常日剂量继续服药。
给药方法:
本品为口服,不得咀嚼、溶解或打开软胶囊,应当用水送服整粒胶囊,空腹或同餐服用均可。
产品介绍
HP518是公司基于PROTAC核心技术平台,自主研发的针对新型内分泌治疗(NHA)失败的晚期前列腺癌的AR PROTAC分子。HP518能同时降解野生型AR和点突变型AR,目前研究数据表明其具有以下优势:①稳定性好;②具有良好的口服生物利用度;③降解 AR 活性高,DC50达到pmol级;④肿瘤组织暴露量高,成药性强;具有解决晚期前列腺癌症患者因AR突变导致耐药性的潜力;同时由于PROTAC的药物作用机制为通过 AR 降解完全消除AR功能,对AR的抑制作用更强。截至本报告披露日,HP518已在澳大利亚完成用于治疗转移性去势抵抗性前列腺癌(mCRPC)的Ⅰ期临床试验,澳大利亚临床Ⅰ期阶段性数据入选2024年1月美国临床肿瘤学会泌尿生殖系统肿瘤研讨会(ASCO-GU),并入选2024年美国ASCO年会。临床数据显示,HP518拥有良好的安全性和耐受性,在mCRPC患者中表现出有效性信号。此外,HP518同适应症临床试验申请已于2023年1月获FDA批准,中国Ⅰ/Ⅱ期临床试验申请已于2023年11月获NMPA批准。2023年12月,在中国完成首例受试者给药,是国内首个进入临床试验阶段的口服AR PROTAC在研药物。2024年6月,HP518用于AR阳性三阴乳腺癌获美国FDA授予快速通道认定。
患者招募
适应症:转移性去势抵抗性前列腺癌
当前进展:临床Ⅰ/Ⅱ期
国家药物临床试验登记与信息公示平台信息:http://www.chinadrugtrials.org.cn/index.html







